STRUKTUR ATOM POLIELEKTRON
Pendahuluan
- Struktur
atom merupakan satuan dasar materi yang terdiri dari inti atom beserta awan
elektron bermuatan negatif yang mengelilinginya.
- Istilah
atom berasal dari Bahasa Yunani, yang berarti tidak dapat dipotong ataupun
sesuatu yang tidak dapat dibagi-bagi lagi
- Teori
atom mekanika kuantum tidak berhasil menyelsaikan masalah atom polielektron
secara eksek, kesulitanya adalah dengan bertambahnya jumlah elektron
menimbulkan bakutarik antara elektron-inti dan baku tolak antara
elektron-elektron yang makin rumit,
- Cara
menagani masalah atom polielektron di gunakan metode pendekatan,yaitu
menjadikan atom hidrogen yang telah di selsaikan secara eksek sebagai dasar,
kemudian antar aksi yang lain di masukkan secara sistematis kedalam perhitungan
( “SELF-CONSISTENCIES FIELD ( SCF)")
Pengertian dan Penjelasan
Atom tersusun dari :
1. Inti atom (berupa proton & neutron )
2. Kulit atom yg mengandung elektron-elektron,
Elektron (-) yang berada pada lintasan-lintasan tertentu bergerak mengelilingi
inti atom (+), Jumlah elektron sama dengan jumlah proton sehinga secara
keseluruhan atom bersifat netral
Kulit terdiri atas
subkulit yang berisi orbital-orbital dengan bilangan kuantum utama yang sama.
Jumlah orbital dalam setiap kulit dinyatakan dengan rumus n^2 dan jumlah
maksimum elektron yang dapat menempati setiap kulit dinyatakan dengan rumus 2n^2
Contoh
Berapa jumlah orbital dan jumlah
maksimum elektron dalam kulit M?
Penyelesaian:
Kulit M memiliki bilangan
kuantum, n = 3 maka jumlah orbital dalam kulit M adalah 32 = 9 orbital dan
jumlah maksimum elektronnya sebanyak 2(3)^2= 18 elektron
Konfigurasi
elektron
Pada mekanika gelombang atau mekanika kuantum, elektron-elektron dalam suatu atom akan tersebar ke dalam orbital-orbital (s, p, d, f, dan seterusnya). Bagaimana pengisian elektron ke dalam orbital? Pengisian orbital oleh electron mengikuti aturan dengan memperhatikan tiga hal, yaitu asas AufBau, asas larangan Pauli, dan asas Hund.
a. Asas AufBau
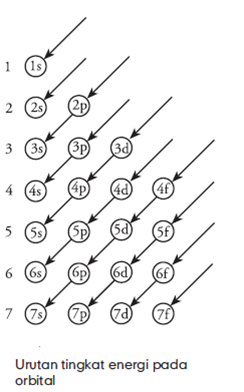
Menurut asas AufBau, pada kondisi normal
atau pada tingkat dasar, elektron akan menempati orbital yang memiliki
energy terendah terlebih dahulu dan diteruskan ke orbital yang memiliki
energi lebih tinggi. Untuk memudahkan dalam pengisian electron diberikan
tahap-tahap pengisian elektron dengan menggunakan jembatan ingatan
sebagai berikut;
Arah
anak panah menyatakan urutan pengisian orbital. Dengan demikian urutan
pengisian elektron berdasarkan gambar tersebut berurut-urut 1s, 2s, 2p,
3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, dan seterusnya. Pengisian elektron harus
satu persatu dan setiap orbital hanya boleh diisi oleh maksimal 2
elektron.
b. Asas larangan Pauli
Pauli mengemukakan hipotesisnya yang
menyatakan bahwa dalam satu atom tidak mungkin dua elektron mempunyai
keempat bilangan kuantum sama. Misal, 2 elektron akan menempati subkulit
1s. Tiga bilangan kuantum pertama akan mempunyai nilai yang sama (n =
1, l = 0, m = 0). Untuk itu bilangan kuantum yang terakhir, yaitu
bilangan kuantum spin(s) harus mempunyai nilai berbeda +1/2 dan -1/2.
Dengan kata lain, setiap orbital maksimal
hanya dapat terisi 2 elektron dengan arah spin berlawanan. Sebagai
contoh, pengisian elektron pada orbital 1s digambarkan sebagai berikut:

Mengapa pada satu orbital hanya dapat
ditempati maksimal oleh dua elektron? Karena jika ada elektron ketiga,
maka electron tersebut pasti akan mempunyai spin yang sama dengan salah
satu elektron yang terdahulu dan itu akan melanggar asas larangan Pauli
dengan demikian tidak dibenarkan. Jumlah elektron maksimal untuk tiap
subkulit sama dengan dua kali dari jumlah orbitalnya.
- Orbital s maksimal 2 elektron,
- Orbital p maksimal 6 elektron,
- Orbital d maksimal 10 elektron, dan
- Orbital f maksimal 14 elektron,
c. Asas Hund
Frederick Hund, 1927 (dikenal Hund)
mengatakan bahwa pengisian elektron pada orbital yang setingkat
(energinya sama) dalam satu orbital adalah satu per satu dengan arah
spin yang sama sebelum berpasangan. Asas ini dikemukakan berdasarkan
penalaran bahwa energi tolak-menolak antara dua elektron akan minimum
jika jarak antara elektron berjauhan. Untuk lebih memahaminya,
perhatikan gambaran pengisian elektron pada orbital p.
Contoh pengisian yang benar:

Contoh pengisian yang salah
Untuk
penulisan konfigurasi elektron yang mempunyai jumlah elektron besar
dapat dilakukan penyederhanaan. Penyederhanaan dilakukan dengan
menuliskan simbol dari unsur gas mulia yang mempunyai nomor atom di
bawahnya, diikuti dengan penulisan kekurangan jumlah elektron setelah
gas mulia tersebut.

d. Penyimpangan konfigurasi elektron
Berdasarkan eksperimen, terdapat
penyimpangan konfigurasi elektron dalam pengisian elektron. Penyimpangan
pengisian elektron ditemui pada elektron yang terdapat pada orbital
subkulit d dan f. Penyimpangan pada orbital subkulit d dikarenakan
orbital yang setengah penuh (d5) atau penuh (d10) bersifat lebih stabil
dibandingkan dengan orbital yang hampir setengah penuh (d4) atau hampir
penuh (d8 atau d9). Dengan demikian, jika electron terluar berakhir pada
d4, d8 atau d9 tersebut, maka satu atau semua elektron pada orbital s
(yang berada pada tingkat energy yang lebih rendah dari d) pindah ke
orbital subkulit d. Lihat beberapa contoh dalam Tabel 1.4.
Tabel 1.4 Penyimpangan pada orbital d
Pada
orbital f , sebagaimana dengan penyimpangan konfigurasi dalam orbital
d, maka konfigurasi elektron yang berakhir pada orbital f juga mengalami
penyimpangan. Penyimpangan dalam pengisian elektron dalam orbital ini
disebabkan oleh tingkat energi orbital saling berdekatan hamper sama.
Penyimpangan ini berupa berpindahnya satu atau dua elektron dari orbital
f ke orbital d. Lihat beberapa contoh dalam Tabel 1.5
Tabel 1.5 Penyimpangan pada orbital f.

e. Penulisan konfigurasi elektron pada ion
Penulisan konfigurasi elektron di atas
berlaku pada atom netral. Penulisan konfigurasi elektron pada ion yang
bermuatan pada dasarnya sama dengan penulisan konfigurasi elektron pada
atom netral. Atom bermuatan positif (misalnya +x) terbentuk karena atom
netral melepaskan elektron pada kulit terluarnya sebanyak x, sedangkan
ion negatif (misalnya –y) terbentuk karena menarik elektron sebanyak y.
Penulisan konfigurasi elektronnya hanya menambah atau mengurangi
elektron yang dilepas atau ditambah sesuai dengan aturan penulisan
konfigurasi elektron. Ini berlaku untuk semua unsur yang membentuk ion,
termasuk unsur transisi.
Perhatikan contoh berikut:
Diagram Tingkat Energi Orbitan
Orbital Atom
Orbit dan orbital kedengarannya serupa,
padahal keduanya memiliki arti yang agak berbeda. Merupakan hal yang
ukup penting untuk mengerti perbedaan tersebut.
 Ketidakmungkinan menggambar orbit dari elektron
Ketidakmungkinan menggambar orbit dari elektron
Untuk
menggambar jalur dari sesuatu anda perlu tahu dengan tepat dimana objek
tersebut berada dan akan berada dimana objek tersebut beberapa saat
kemudian. Hal ini tidak dapat dilakukan untuk elektron.
Prinsip ketidakpastian Heisenberg
mengatakan bahwa tidak dapat ditentukan dengan tepat dimana dan akan
kemana sebuah elektron. Itu menjadikan tidak mungkin untuk menggambar
orbit dari elektron di sekitar nukleus. Tapi, apakah ini masalah yang
besar? Tidak. Jika sesuatu tidak mungkin anda harus menerimanya dan
mencari pemecahan dari masalah tersebut.
 Elektron hidrogen -orbital 1s
Elektron hidrogen -orbital 1s
 Anggap
anda memiliki sebuah atom hydrogen dan pada suatu saat tertentu anda
menggambar posisi dari satu elektron tersebut. Beberapa saat kemudian
anda melakukan hal yang sama dan menemukannya sudah berada di posisi
yang baru. Anda mungkin tidak mengerti bagaimana ele tron tersebut
berpindah dari posisi pertama ke posisi kedua.
Anggap
anda memiliki sebuah atom hydrogen dan pada suatu saat tertentu anda
menggambar posisi dari satu elektron tersebut. Beberapa saat kemudian
anda melakukan hal yang sama dan menemukannya sudah berada di posisi
yang baru. Anda mungkin tidak mengerti bagaimana ele tron tersebut
berpindah dari posisi pertama ke posisi kedua.
Anda melakukan hal
ini berulang-ulang kali dan pelan-pelan anda akan dapat menemukan suatu
peta 3D dari letak elektron tersebut.
Pada kasus hidrogen
Elektron dapat ditemukan dimanapun di dalam ruangan bola disekitar
nukleus. Diagram diatas menggambarkan potongan melintang dari ruangan
bola tersebut.
95% dari keseluruhan waktu (atau mungkin persentase
lain yang anda pilih) elektron dapat ditemukan dengan mudah di daerah
dekat dengan nu leus. Daerah seperti itu yang disebut dengan orbital. Anda dapat membayangkannya sebagai suatu daerah dimana elekron berada.
Apa
yang elektron lakukan di orbital? Kita tidak tahu dan kita tidak bisa
tahu. Jadi kita tidak akan membahas tentang hal tersebut. Yang bisa kita
katakan hanyalah bila elektron berada di suatu orbital tertentu
elektron tersebut akan memiliki tingkat energi tertentu. Tiap tingkat
energi memiliki nama masing- masing.
Orbital yang dimiliki oleh ele tron hydrogen disebut sebagai orbital 1s. Angka 1 melambangkan bahwa orbital tersebut berada pada level energi terdekat dari nukleus. Dan huruf s
melambangkan bentuk dari orbital tersebut. Orbital s berbentuk sebuah
bola yang simetris di sekitar nukleus yang pada kasus tertentu seperti
bola dengan isi yang kosong dengan nukleus sebagai pusatnya.
 Orbital pada gambar diatas adalah orbital 2s.
Sama seperti orbital 1s kecuali daerah dimana elektron mungkin berada
lebih jauh dari nukleus orbital ini berada pada tingkat energi kedua.
Orbital pada gambar diatas adalah orbital 2s.
Sama seperti orbital 1s kecuali daerah dimana elektron mungkin berada
lebih jauh dari nukleus orbital ini berada pada tingkat energi kedua.
Jika
anda mengamati dengan seksama anda akan menemukan adanya suatu daerah
dengan kepadatan elektron yang lebih besar (dimana titik-titik menjadi
padat) disekitar nukleus. (“Kepadatan elektron” adalah cara lain
menemkan elektron pada daerah tertentu.)
2s (juga 3s, 4s, dsb)
elektron menghabiskan waktu di daerah yang lebih dekat dengan nukleus
lebih dari yang anda bayangkan. Efek ini untuk sedikit mengurangi energi
yang dipakai oleh elektron pada orbital s. Makin dekat dengan nukleus.
Makin kecil energi yang diperlukan.
Orbital 3s, 4s (dsb) secara progresif makin jauh dari nukleus.
 Orbital p
Orbital p
Tidak
semua elektron berada pada orbital s. (Bahkan hanya sedikit). Pada
tingkat energi yang pertama, satu-satunya orbital hanya cukup untuk
orbital 1s. Tetapi pada tingkat 2, selain orbital 2s ada juga orbital
lain yang disebut orbital 2p.
Orbital p seperti dua
balon identik yang diikat pada bagian tengah. Diagram disamping adalah
potongan melintang dari struktur 3D daerah tersebut. Sekali lagi orbital
tersebut menunjukkan daerah dimana elektron 95% dapat ditemukan.
Tidak seperti orbital s, orbital p menunjuk ke arah arah tertentu.
Pada
setiap tingkat energi ada tiga kemungkinan dari orbital p yang sama
yang sama yang saling tegak lurus. Secara acak diberi nama sebagai px, py dan pz.
Nama ini semata-mata hanya untuk memudahkan apa yang anda pikir
sebagai arah x,y,z berganti secara terus menerus karena rotasi atom di
ruang.
Orbital p pada tingkat dua disebut sebagai 2px, 2py dan 2pz. Dan pada tingkat yang lain disebut sebagai 3px, 3py, 3pz, 4px, 4py, 4pz dan seterusnya.
Semua
level memiliki orbital p kecuali level satu. Pada level yang lebih
tinggi elekton lebih banyak ditemukan pada jarak yang jauh dari nukleus.
 Memasukkan elektron kedalam orbital.
Memasukkan elektron kedalam orbital.
Karena
pada saat ini kita hanya tertarik pada struktur elektron dari hydrogen
dan karbon, kita tidak perlu memikirkan apa yang terjadi diatas level
energi tingkat dua.
Ingat:
Pada level 1 hanya ada satu orbital – orbital 1s.
Pada level empat ada empat orbital -orbital 2s, 2px, 2py and 2pz.
Tiap orbital mengandung 1 atau 2 elektron. Tidak lebih dari itu.
 Elektron dalam kotak
Elektron dalam kotak
Orbital dapat diwakili dengan kotak dan elektron dengan anak panah. Arah anak panah menunjukkan arah elektron yang berlawanan.
 Orbital 1s yang memiliki 2 elektron dapat ditunjukkan seperti gambar disamping, atau bisa juga ditulis lebih ringkas dengan 1s2. Dibaca “satu s dua”, bukan “satu s kuadrat”.
Orbital 1s yang memiliki 2 elektron dapat ditunjukkan seperti gambar disamping, atau bisa juga ditulis lebih ringkas dengan 1s2. Dibaca “satu s dua”, bukan “satu s kuadrat”.

 Urutan dalam mengisi orbital
Urutan dalam mengisi orbital
Elektron
mengisi orbital energi rendah (yang dekat dengan nukleus) sebelum
mengisi orbital di tingkat energi yang lebih tinggi. Saat ada pilihan
antara orbital dengan tingkat energi yang sama elektron mengisi orbital
satu satu sejauh mungkin.
Diagram berikut menunjukkan energi dari orbital di tingkat satu dan tingkat dua.
 Perhatikan
bahwa orbital 2s memiliki energi yang sedikit lebih rendah dari orbital
2p. Ini berarti bahwarbital 2s akan penuh dengan elektron terlebih
dahulu sebelum orbital 2p. Semua orbital 2p memiliki tingkat energi yang
sama.
Perhatikan
bahwa orbital 2s memiliki energi yang sedikit lebih rendah dari orbital
2p. Ini berarti bahwarbital 2s akan penuh dengan elektron terlebih
dahulu sebelum orbital 2p. Semua orbital 2p memiliki tingkat energi yang
sama.
 Struktur elektron dari Hidrogen
Struktur elektron dari Hidrogen
Hidrogen hanya memiliki satu elektron dan itu akan mengisi orbital dengan tingkat energi terendah yaitu orbital 1s.
Struktur elektron hydrogen adalah 1s1. Kita telah bahas hal ini sebelumnya.

 Struktur Elektron dari Karbon
Struktur Elektron dari Karbon
Karbon
memiliki enam buah elektron. Dua pada orbital 1s dari molekul. Lalu dua
yang selanjutnya pada orbital 2s. Sisanya akan terbagi satu satu dalam
orbital 2p. Hal ini karena orbital 2p memiliki tingkat energi yang sama
dan stabil pada keadaan sendiri.
Struktur elektron Karbon biasanya ditulis sebagai 1s22s22px12py1.